新聞中心
(2015年度)國家醫(yī)療器械不良事件監(jiān)測年度報告
2015年,全國醫(yī)療器械不良事件監(jiān)測工作繼續(xù)穩(wěn)步發(fā)展,全年可疑醫(yī)療器械不良事件報告數(shù)已超過32萬份。在報告數(shù)量持續(xù)增長的同時,報告質(zhì)量也不斷提升,為醫(yī)療器械上市后風(fēng)險的分析與評價提供了依據(jù)。
(一)2015年全國可疑不良事件報告總體情況
2015年,國家藥品不良反應(yīng)監(jiān)測中心共收到《可疑醫(yī)療器械不良事件報告表》321,254份,比2014年增長了21.1%。2002年1月1日至2015年12月31日,國家藥品不良反應(yīng)監(jiān)測中心累計收到《可疑醫(yī)療器械不良事件報告表》1,322,059份(圖1-1)。
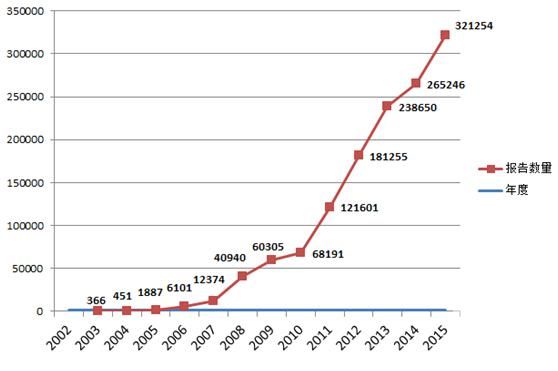
圖1-1 2002-2015年全國可疑醫(yī)療器械不良事件報告數(shù)量
1、死亡及嚴(yán)重傷害可疑不良事件報告數(shù)量
2015年,國家藥品不良反應(yīng)監(jiān)測中心共收到死亡可疑不良事件報告184份,嚴(yán)重傷害可疑不良事件報告47,065份,共計47,249份,比2014年增長了15.2%(圖1-2)。2015年死亡及嚴(yán)重傷害可疑不良事件報告數(shù)量占報告總數(shù)的比例為14.7%,比2014年下降了0.8%。
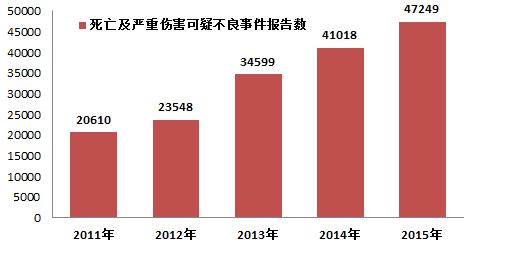
圖1-2 2011-2015年全國死亡及嚴(yán)重傷害可疑不良事件報告數(shù)比較
2、每百萬人口平均報告數(shù)量
2015年,我國每百萬人口平均可疑醫(yī)療器械不良事件報告數(shù)為240份,與2014年相比增長了42份(圖1-3)。
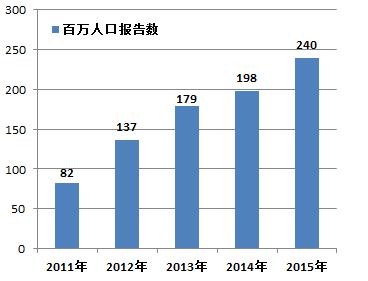
圖1-3 2011-2015年全國每百萬人口平均報告數(shù)比較
3、注冊基層用戶數(shù)量
截止2015年12月31日,在全國醫(yī)療器械不良事件監(jiān)測系統(tǒng)中,注冊基層用戶(包括醫(yī)療器械生產(chǎn)企業(yè)、經(jīng)營企業(yè)和使用單位)共198, 536家。其中,醫(yī)療器械生產(chǎn)企業(yè)10,344家,占注冊基層用戶總數(shù)的5.2%;經(jīng)營企業(yè)91,322家,占注冊基層用戶的46.0%;使用單位96,870家,占注冊基層用戶的48.8%(圖1-4)。
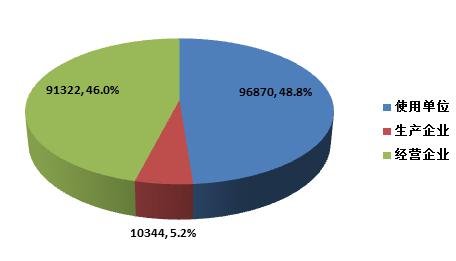
圖1-4 2015年全國醫(yī)療器械不良事件監(jiān)測系統(tǒng)注冊基層用戶情況
2015年,注冊基層用戶(包括醫(yī)療器械生產(chǎn)企業(yè)、經(jīng)營企業(yè)和使用單位)總數(shù)比2014年增長了13.9%。其中,醫(yī)療器械生產(chǎn)企業(yè)、經(jīng)營企業(yè)和使用單位的注冊基層用戶分別比2014年增長了11.8%、21.8%和7.5%(圖1-5)。
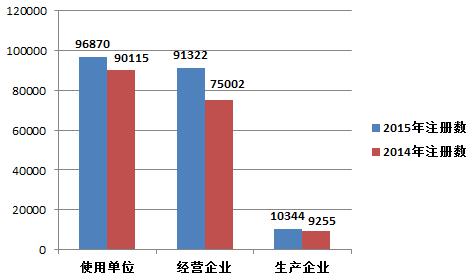
圖1-5 2014年和2015年全國注冊基層用戶分類比較情況
二、2015年醫(yī)療器械不良事件報告統(tǒng)計分析
(一)按報告來源統(tǒng)計分析
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,使用單位上報259,219份,占總報告數(shù)的80.6%;生產(chǎn)企業(yè)上報5,352份,占總報告數(shù)的1.7%;經(jīng)營企業(yè)上報56,315份,占總報告數(shù)的17.5%;還有364份報告來自于個人,占總報告數(shù)的0.1%;此外還有4份報告來源不詳(圖2-1)。
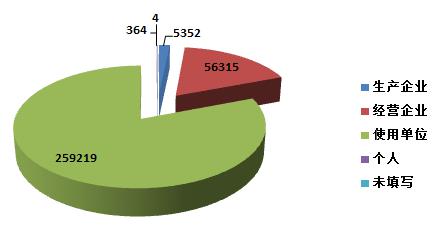
圖2-1 2015年醫(yī)療器械不良事件報告來源情況
總體來看,不良事件報告仍主要來源于使用單位。相比2014年,生產(chǎn)企業(yè)提交的報告所占比例有所下降,與其器械使用安全第一責(zé)任人的地位不符,其履行職責(zé)的自覺性有待提高。
(二)按事件傷害程度統(tǒng)計分析
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,事件傷害為死亡的報告共184份,占總報告數(shù)的0.05%;事件為嚴(yán)重傷害的報告共47,065份,占總報告數(shù)的14.7%;事件傷害為其他的報告共274,005份,占總報告數(shù)的85.2%(圖2-2)。2015年,各類傷害程度的報告絕對數(shù)量均有所增加,其所占比例與2014年相似。
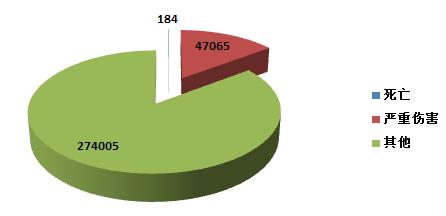
圖2-2 2015年醫(yī)療器械不良事件報告事件傷害程度情況
(三)按醫(yī)療器械管理類別統(tǒng)計分析
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,涉及Ⅲ類醫(yī)療器械的報告133,548份,占總報告數(shù)的41.6%;涉及Ⅱ類醫(yī)療器械的報告126,284份,占總報告數(shù)的39.3%;涉及Ⅰ類醫(yī)療器械的報告50,213份,占總報告數(shù)的15.6%;部分報告涉及的器械管理類別不詳,共11,209份,占總報告數(shù)的3.5%。數(shù)據(jù)顯示,涉及Ⅲ類和Ⅱ類醫(yī)療器械的報告占絕大多數(shù),這與醫(yī)療器械風(fēng)險程度高低相吻合(圖2-3)。
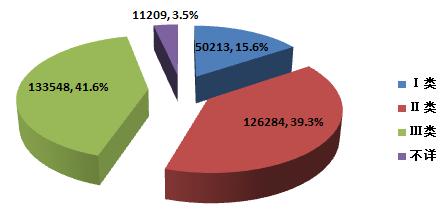
圖2-3 2015年醫(yī)療器械不良事件報告涉及產(chǎn)品管理類別情況
(四)按醫(yī)療器械分類目錄統(tǒng)計分析
按照現(xiàn)行的《醫(yī)療器械分類目錄》,2015年全國上報的可疑醫(yī)療器械不良事件報告共涉及43類產(chǎn)品,涵蓋了《醫(yī)療器械分類目錄》中的所有醫(yī)療器械類別。其中,報告數(shù)量位列前十位的產(chǎn)品類別見表2-1。與2014年相比,報告數(shù)量排名前十位的產(chǎn)品類別沒有變化,僅部分產(chǎn)品類別的排名略有變化。
表2-1 2015年醫(yī)療器械不良事件報告數(shù)量排名前十位的產(chǎn)品類別情況
(五)按醫(yī)療器械產(chǎn)品名稱統(tǒng)計分析
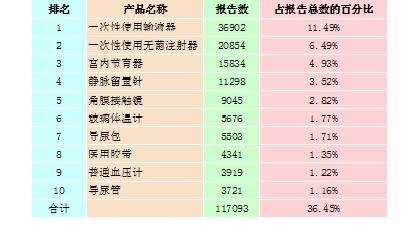
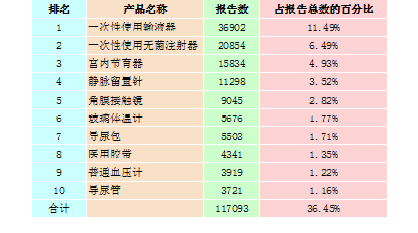
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,報告數(shù)量排名前十位的無源醫(yī)療器械分別為一次性使用輸液器、一次性使用無菌注射器、宮內(nèi)節(jié)育器、靜脈留置針、角膜接觸鏡、玻璃體溫計、導(dǎo)尿包、醫(yī)用膠帶、普通血壓計和導(dǎo)尿管,占總報告數(shù)的36.45%,詳見表2-2。
表2-2 報告數(shù)量排名前十位的無源醫(yī)療器械
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,報告數(shù)量排名前十位的有源醫(yī)療器械分別為病人監(jiān)護(hù)儀、輸液泵和注射泵、電子血壓計、血液透析機(jī)、心電圖機(jī)、血糖儀、呼吸機(jī)、電子體溫計、嬰兒培養(yǎng)箱和微波治療機(jī),占總報告數(shù)的7.23%。
(六)按涉及實(shí)際使用場所統(tǒng)計分析
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,使用場所為“醫(yī)療機(jī)構(gòu)”的報告232,641份,占72.4%;使用場所為“家庭”的報告39,632份,占12.3%;使用場所為“其他”的報告8,438份,占2.6%;使用場所未填寫的報告40,543份,占12.6%(圖2-4)。使用場所的復(fù)雜性是分析不良事件發(fā)生原因時需要考量的因素之一。
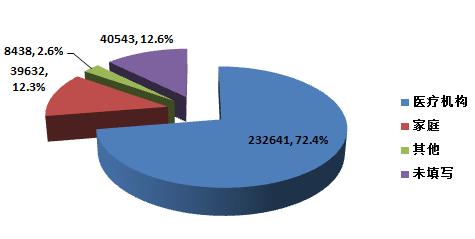
圖2-4 2015年醫(yī)療器械不良事件報告涉及實(shí)際使用場所情況
三、2015年醫(yī)療器械風(fēng)險評價及采取的主要措施情況
(一)發(fā)布《醫(yī)療器械不良事件信息通報》
2015年,總局共發(fā)布3期《醫(yī)療器械不良事件信息通報》,涉及醫(yī)用血管造影x射線機(jī)、體外除顫器和低頻電磁治療設(shè)備三類產(chǎn)品。
醫(yī)用血管造影X射線機(jī)的臨床使用風(fēng)險主要表現(xiàn)為造影機(jī)故障。這些故障主要包括無射線,設(shè)備無法啟動、死機(jī)、自動關(guān)機(jī),圖像不清晰,圖像不能保存,機(jī)架臂無法鎖死,手術(shù)床無法移動等。其中以球管和操作臺的故障報告最多。為減少不良事件重復(fù)發(fā)生造成傷害的風(fēng)險,建議生產(chǎn)企業(yè)在產(chǎn)品設(shè)計中,增加對易老化、易損耗部件狀態(tài)的監(jiān)測,必要時增加報警信息,以便于使用者及時識別;加強(qiáng)對醫(yī)療機(jī)構(gòu)的使用培訓(xùn),包括設(shè)備的操作規(guī)程、運(yùn)行環(huán)境要求、易損件的使用壽命等。建議醫(yī)療機(jī)構(gòu)詳細(xì)閱讀設(shè)備使用說明書,熟悉操作規(guī)程和使用注意事項,嚴(yán)格按照使用說明書的要求保證設(shè)備運(yùn)行環(huán)境。
體外除顫器臨床使用風(fēng)險主要表現(xiàn)為:心臟除顫功能失效、監(jiān)視器或記錄器失效或受擾紊亂。為減少不良事件重復(fù)發(fā)生造成傷害的風(fēng)險,提醒使用單位根據(jù)相關(guān)國家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn),及所使用體外除顫器的隨機(jī)文件要求,建立并嚴(yán)格執(zhí)行體外除顫器的日常維護(hù)機(jī)制;生產(chǎn)企業(yè)應(yīng)考慮除顫器的特殊性(高風(fēng)險、不常使用),盡量通過“機(jī)宜人”的設(shè)計使產(chǎn)品易于維護(hù),并且加強(qiáng)關(guān)鍵部件的可靠性設(shè)計,以減少設(shè)備故障的發(fā)生。
低頻電磁治療設(shè)備臨床使用風(fēng)險主要以電能危害為主,其中人員傷害的主要表現(xiàn)為皮膚過敏、燙傷、灼傷、刺痛、疼痛及肌肉麻木等;器械故障的主要表現(xiàn)有:漏電,無輸出或輸出不穩(wěn)定,電極片、導(dǎo)聯(lián)線損壞等。為加強(qiáng)低頻電磁治療設(shè)備的安全使用,減少不良事件的發(fā)生,提醒使用者:1.嚴(yán)格控制適應(yīng)癥及禁忌癥,按照產(chǎn)品使用說明書正確使用,切勿超輸出功率、超時長等非正常使用,確保設(shè)備的使用環(huán)境和使用條件符合要求;2.加強(qiáng)設(shè)備的日常檢查和維護(hù)保養(yǎng),及時更換易損、易耗件。
(二)發(fā)布《醫(yī)療器械警戒快訊》
2015年,國家藥品不良反應(yīng)監(jiān)測中心共發(fā)布9期《醫(yī)療器械警戒快訊》,包括52條國外醫(yī)療器械監(jiān)管機(jī)構(gòu)發(fā)布的安全性信息,涉及血管內(nèi)回收鉗、麻醉呼吸回路、除顫器、胰島素泵、呼吸機(jī)、人工晶體等產(chǎn)品。
醫(yī)療器械不良事件監(jiān)測小貼士
1.醫(yī)療器械:是指直接或者間接用于人體的儀器、設(shè)備、器具、體外診斷試劑及校準(zhǔn)物、材料以及其他類似或者相關(guān)的物品,包括所需要的計算機(jī)軟件;其效用主要通過物理等方式獲得,不是通過藥理學(xué)、免疫學(xué)或者代謝的方式獲得,或者雖然有這些方式參與但是只起輔助作用;其目的是:
(1)疾病的診斷、預(yù)防、監(jiān)護(hù)、治療或者緩解;
(2)損傷的診斷、監(jiān)護(hù)、治療、緩解或者功能補(bǔ)償;
(3)生理結(jié)構(gòu)或者生理過程的檢驗(yàn)、替代、調(diào)節(jié)或者支持;
(4)生命的支持或者維持;
(5)妊娠控制;
(6)通過對來自人體的樣本進(jìn)行檢查,為醫(yī)療或者診斷目的提供信息。
2.醫(yī)療器械不良事件:指獲準(zhǔn)注冊或已備案、質(zhì)量合格的醫(yī)療器械,在正常使用情況下發(fā)生的,導(dǎo)致或可能導(dǎo)致人體傷害的各種有害事件。
根據(jù)醫(yī)療器械不良事件的危害程度和發(fā)生的原因,醫(yī)療器械生產(chǎn)企業(yè)必要時應(yīng)當(dāng)采取警示、檢查、修理、重新標(biāo)簽、修改說明書、軟件升級、替換、收回、銷毀等控制措施。
目前,我國醫(yī)療器械不良事件監(jiān)測按照“可疑即報”原則收集報告,即為可疑醫(yī)療器械不良事件報告。
3.醫(yī)療器械不良事件監(jiān)測:是指對醫(yī)療器械不良事件的發(fā)現(xiàn)、報告、調(diào)查、評價和控制的過程。
4.嚴(yán)重醫(yī)療器械不良事件:指有下列情況之一者:
(1)導(dǎo)致死亡;
(2)危及生命;
(3)導(dǎo)致機(jī)體功能的永久性傷害或者機(jī)體結(jié)構(gòu)的永久性損傷;
(4)必須采取醫(yī)療措施才能避免上述永久性傷害或者損傷;
(5)由于醫(yī)療器械故障、可用性等問題可能導(dǎo)致上述所列情況的。
5.醫(yī)療器械不良事件與質(zhì)量事故、醫(yī)療事故的區(qū)別
(1)醫(yī)療器械不良事件主要是由于產(chǎn)品的設(shè)計缺陷、已經(jīng)注冊審核的使用說明書不準(zhǔn)確或不充分等原因造成的,但其產(chǎn)品的質(zhì)量是合格的。
(2)醫(yī)療器械質(zhì)量事故主要是指其質(zhì)量不符合注冊產(chǎn)品標(biāo)準(zhǔn)等規(guī)定造成的事故。
(3)醫(yī)療事故是指醫(yī)療機(jī)構(gòu)及其醫(yī)務(wù)人員在醫(yī)療活動中,違反醫(yī)療衛(wèi)生管理法律、行政法規(guī)、部門規(guī)章和診療護(hù)理規(guī)范、常規(guī),過失造成患者人身損害的事故。(摘自衛(wèi)生部《醫(yī)療事故處理條例》)
6.平均百萬人口報告數(shù):平均每1百萬人口中收到的可疑醫(yī)療器械不良事件報告數(shù)。
發(fā)布于:2016-06-02來源:
一、全國醫(yī)療器械不良事件報告總體情況2015年,全國醫(yī)療器械不良事件監(jiān)測工作繼續(xù)穩(wěn)步發(fā)展,全年可疑醫(yī)療器械不良事件報告數(shù)已超過32萬份。在報告數(shù)量持續(xù)增長的同時,報告質(zhì)量也不斷提升,為醫(yī)療器械上市后風(fēng)險的分析與評價提供了依據(jù)。
(一)2015年全國可疑不良事件報告總體情況
2015年,國家藥品不良反應(yīng)監(jiān)測中心共收到《可疑醫(yī)療器械不良事件報告表》321,254份,比2014年增長了21.1%。2002年1月1日至2015年12月31日,國家藥品不良反應(yīng)監(jiān)測中心累計收到《可疑醫(yī)療器械不良事件報告表》1,322,059份(圖1-1)。

圖1-1 2002-2015年全國可疑醫(yī)療器械不良事件報告數(shù)量
1、死亡及嚴(yán)重傷害可疑不良事件報告數(shù)量
2015年,國家藥品不良反應(yīng)監(jiān)測中心共收到死亡可疑不良事件報告184份,嚴(yán)重傷害可疑不良事件報告47,065份,共計47,249份,比2014年增長了15.2%(圖1-2)。2015年死亡及嚴(yán)重傷害可疑不良事件報告數(shù)量占報告總數(shù)的比例為14.7%,比2014年下降了0.8%。

圖1-2 2011-2015年全國死亡及嚴(yán)重傷害可疑不良事件報告數(shù)比較
2、每百萬人口平均報告數(shù)量
2015年,我國每百萬人口平均可疑醫(yī)療器械不良事件報告數(shù)為240份,與2014年相比增長了42份(圖1-3)。

圖1-3 2011-2015年全國每百萬人口平均報告數(shù)比較
3、注冊基層用戶數(shù)量
截止2015年12月31日,在全國醫(yī)療器械不良事件監(jiān)測系統(tǒng)中,注冊基層用戶(包括醫(yī)療器械生產(chǎn)企業(yè)、經(jīng)營企業(yè)和使用單位)共198, 536家。其中,醫(yī)療器械生產(chǎn)企業(yè)10,344家,占注冊基層用戶總數(shù)的5.2%;經(jīng)營企業(yè)91,322家,占注冊基層用戶的46.0%;使用單位96,870家,占注冊基層用戶的48.8%(圖1-4)。

圖1-4 2015年全國醫(yī)療器械不良事件監(jiān)測系統(tǒng)注冊基層用戶情況
2015年,注冊基層用戶(包括醫(yī)療器械生產(chǎn)企業(yè)、經(jīng)營企業(yè)和使用單位)總數(shù)比2014年增長了13.9%。其中,醫(yī)療器械生產(chǎn)企業(yè)、經(jīng)營企業(yè)和使用單位的注冊基層用戶分別比2014年增長了11.8%、21.8%和7.5%(圖1-5)。

圖1-5 2014年和2015年全國注冊基層用戶分類比較情況
二、2015年醫(yī)療器械不良事件報告統(tǒng)計分析
(一)按報告來源統(tǒng)計分析
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,使用單位上報259,219份,占總報告數(shù)的80.6%;生產(chǎn)企業(yè)上報5,352份,占總報告數(shù)的1.7%;經(jīng)營企業(yè)上報56,315份,占總報告數(shù)的17.5%;還有364份報告來自于個人,占總報告數(shù)的0.1%;此外還有4份報告來源不詳(圖2-1)。

圖2-1 2015年醫(yī)療器械不良事件報告來源情況
總體來看,不良事件報告仍主要來源于使用單位。相比2014年,生產(chǎn)企業(yè)提交的報告所占比例有所下降,與其器械使用安全第一責(zé)任人的地位不符,其履行職責(zé)的自覺性有待提高。
(二)按事件傷害程度統(tǒng)計分析
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,事件傷害為死亡的報告共184份,占總報告數(shù)的0.05%;事件為嚴(yán)重傷害的報告共47,065份,占總報告數(shù)的14.7%;事件傷害為其他的報告共274,005份,占總報告數(shù)的85.2%(圖2-2)。2015年,各類傷害程度的報告絕對數(shù)量均有所增加,其所占比例與2014年相似。

圖2-2 2015年醫(yī)療器械不良事件報告事件傷害程度情況
(三)按醫(yī)療器械管理類別統(tǒng)計分析
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,涉及Ⅲ類醫(yī)療器械的報告133,548份,占總報告數(shù)的41.6%;涉及Ⅱ類醫(yī)療器械的報告126,284份,占總報告數(shù)的39.3%;涉及Ⅰ類醫(yī)療器械的報告50,213份,占總報告數(shù)的15.6%;部分報告涉及的器械管理類別不詳,共11,209份,占總報告數(shù)的3.5%。數(shù)據(jù)顯示,涉及Ⅲ類和Ⅱ類醫(yī)療器械的報告占絕大多數(shù),這與醫(yī)療器械風(fēng)險程度高低相吻合(圖2-3)。

圖2-3 2015年醫(yī)療器械不良事件報告涉及產(chǎn)品管理類別情況
(四)按醫(yī)療器械分類目錄統(tǒng)計分析
按照現(xiàn)行的《醫(yī)療器械分類目錄》,2015年全國上報的可疑醫(yī)療器械不良事件報告共涉及43類產(chǎn)品,涵蓋了《醫(yī)療器械分類目錄》中的所有醫(yī)療器械類別。其中,報告數(shù)量位列前十位的產(chǎn)品類別見表2-1。與2014年相比,報告數(shù)量排名前十位的產(chǎn)品類別沒有變化,僅部分產(chǎn)品類別的排名略有變化。
表2-1 2015年醫(yī)療器械不良事件報告數(shù)量排名前十位的產(chǎn)品類別情況

(五)按醫(yī)療器械產(chǎn)品名稱統(tǒng)計分析
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,報告數(shù)量排名前十位的無源醫(yī)療器械分別為一次性使用輸液器、一次性使用無菌注射器、宮內(nèi)節(jié)育器、靜脈留置針、角膜接觸鏡、玻璃體溫計、導(dǎo)尿包、醫(yī)用膠帶、普通血壓計和導(dǎo)尿管,占總報告數(shù)的36.45%,詳見表2-2。
表2-2 報告數(shù)量排名前十位的無源醫(yī)療器械

2015年,全國上報的可疑醫(yī)療器械不良事件報告中,報告數(shù)量排名前十位的有源醫(yī)療器械分別為病人監(jiān)護(hù)儀、輸液泵和注射泵、電子血壓計、血液透析機(jī)、心電圖機(jī)、血糖儀、呼吸機(jī)、電子體溫計、嬰兒培養(yǎng)箱和微波治療機(jī),占總報告數(shù)的7.23%。
(六)按涉及實(shí)際使用場所統(tǒng)計分析
2015年,全國上報的可疑醫(yī)療器械不良事件報告中,使用場所為“醫(yī)療機(jī)構(gòu)”的報告232,641份,占72.4%;使用場所為“家庭”的報告39,632份,占12.3%;使用場所為“其他”的報告8,438份,占2.6%;使用場所未填寫的報告40,543份,占12.6%(圖2-4)。使用場所的復(fù)雜性是分析不良事件發(fā)生原因時需要考量的因素之一。

圖2-4 2015年醫(yī)療器械不良事件報告涉及實(shí)際使用場所情況
三、2015年醫(yī)療器械風(fēng)險評價及采取的主要措施情況
(一)發(fā)布《醫(yī)療器械不良事件信息通報》
2015年,總局共發(fā)布3期《醫(yī)療器械不良事件信息通報》,涉及醫(yī)用血管造影x射線機(jī)、體外除顫器和低頻電磁治療設(shè)備三類產(chǎn)品。
醫(yī)用血管造影X射線機(jī)的臨床使用風(fēng)險主要表現(xiàn)為造影機(jī)故障。這些故障主要包括無射線,設(shè)備無法啟動、死機(jī)、自動關(guān)機(jī),圖像不清晰,圖像不能保存,機(jī)架臂無法鎖死,手術(shù)床無法移動等。其中以球管和操作臺的故障報告最多。為減少不良事件重復(fù)發(fā)生造成傷害的風(fēng)險,建議生產(chǎn)企業(yè)在產(chǎn)品設(shè)計中,增加對易老化、易損耗部件狀態(tài)的監(jiān)測,必要時增加報警信息,以便于使用者及時識別;加強(qiáng)對醫(yī)療機(jī)構(gòu)的使用培訓(xùn),包括設(shè)備的操作規(guī)程、運(yùn)行環(huán)境要求、易損件的使用壽命等。建議醫(yī)療機(jī)構(gòu)詳細(xì)閱讀設(shè)備使用說明書,熟悉操作規(guī)程和使用注意事項,嚴(yán)格按照使用說明書的要求保證設(shè)備運(yùn)行環(huán)境。
體外除顫器臨床使用風(fēng)險主要表現(xiàn)為:心臟除顫功能失效、監(jiān)視器或記錄器失效或受擾紊亂。為減少不良事件重復(fù)發(fā)生造成傷害的風(fēng)險,提醒使用單位根據(jù)相關(guān)國家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn),及所使用體外除顫器的隨機(jī)文件要求,建立并嚴(yán)格執(zhí)行體外除顫器的日常維護(hù)機(jī)制;生產(chǎn)企業(yè)應(yīng)考慮除顫器的特殊性(高風(fēng)險、不常使用),盡量通過“機(jī)宜人”的設(shè)計使產(chǎn)品易于維護(hù),并且加強(qiáng)關(guān)鍵部件的可靠性設(shè)計,以減少設(shè)備故障的發(fā)生。
低頻電磁治療設(shè)備臨床使用風(fēng)險主要以電能危害為主,其中人員傷害的主要表現(xiàn)為皮膚過敏、燙傷、灼傷、刺痛、疼痛及肌肉麻木等;器械故障的主要表現(xiàn)有:漏電,無輸出或輸出不穩(wěn)定,電極片、導(dǎo)聯(lián)線損壞等。為加強(qiáng)低頻電磁治療設(shè)備的安全使用,減少不良事件的發(fā)生,提醒使用者:1.嚴(yán)格控制適應(yīng)癥及禁忌癥,按照產(chǎn)品使用說明書正確使用,切勿超輸出功率、超時長等非正常使用,確保設(shè)備的使用環(huán)境和使用條件符合要求;2.加強(qiáng)設(shè)備的日常檢查和維護(hù)保養(yǎng),及時更換易損、易耗件。
(二)發(fā)布《醫(yī)療器械警戒快訊》
2015年,國家藥品不良反應(yīng)監(jiān)測中心共發(fā)布9期《醫(yī)療器械警戒快訊》,包括52條國外醫(yī)療器械監(jiān)管機(jī)構(gòu)發(fā)布的安全性信息,涉及血管內(nèi)回收鉗、麻醉呼吸回路、除顫器、胰島素泵、呼吸機(jī)、人工晶體等產(chǎn)品。
醫(yī)療器械不良事件監(jiān)測小貼士
1.醫(yī)療器械:是指直接或者間接用于人體的儀器、設(shè)備、器具、體外診斷試劑及校準(zhǔn)物、材料以及其他類似或者相關(guān)的物品,包括所需要的計算機(jī)軟件;其效用主要通過物理等方式獲得,不是通過藥理學(xué)、免疫學(xué)或者代謝的方式獲得,或者雖然有這些方式參與但是只起輔助作用;其目的是:
(1)疾病的診斷、預(yù)防、監(jiān)護(hù)、治療或者緩解;
(2)損傷的診斷、監(jiān)護(hù)、治療、緩解或者功能補(bǔ)償;
(3)生理結(jié)構(gòu)或者生理過程的檢驗(yàn)、替代、調(diào)節(jié)或者支持;
(4)生命的支持或者維持;
(5)妊娠控制;
(6)通過對來自人體的樣本進(jìn)行檢查,為醫(yī)療或者診斷目的提供信息。
2.醫(yī)療器械不良事件:指獲準(zhǔn)注冊或已備案、質(zhì)量合格的醫(yī)療器械,在正常使用情況下發(fā)生的,導(dǎo)致或可能導(dǎo)致人體傷害的各種有害事件。
根據(jù)醫(yī)療器械不良事件的危害程度和發(fā)生的原因,醫(yī)療器械生產(chǎn)企業(yè)必要時應(yīng)當(dāng)采取警示、檢查、修理、重新標(biāo)簽、修改說明書、軟件升級、替換、收回、銷毀等控制措施。
目前,我國醫(yī)療器械不良事件監(jiān)測按照“可疑即報”原則收集報告,即為可疑醫(yī)療器械不良事件報告。
3.醫(yī)療器械不良事件監(jiān)測:是指對醫(yī)療器械不良事件的發(fā)現(xiàn)、報告、調(diào)查、評價和控制的過程。
4.嚴(yán)重醫(yī)療器械不良事件:指有下列情況之一者:
(1)導(dǎo)致死亡;
(2)危及生命;
(3)導(dǎo)致機(jī)體功能的永久性傷害或者機(jī)體結(jié)構(gòu)的永久性損傷;
(4)必須采取醫(yī)療措施才能避免上述永久性傷害或者損傷;
(5)由于醫(yī)療器械故障、可用性等問題可能導(dǎo)致上述所列情況的。
5.醫(yī)療器械不良事件與質(zhì)量事故、醫(yī)療事故的區(qū)別
(1)醫(yī)療器械不良事件主要是由于產(chǎn)品的設(shè)計缺陷、已經(jīng)注冊審核的使用說明書不準(zhǔn)確或不充分等原因造成的,但其產(chǎn)品的質(zhì)量是合格的。
(2)醫(yī)療器械質(zhì)量事故主要是指其質(zhì)量不符合注冊產(chǎn)品標(biāo)準(zhǔn)等規(guī)定造成的事故。
(3)醫(yī)療事故是指醫(yī)療機(jī)構(gòu)及其醫(yī)務(wù)人員在醫(yī)療活動中,違反醫(yī)療衛(wèi)生管理法律、行政法規(guī)、部門規(guī)章和診療護(hù)理規(guī)范、常規(guī),過失造成患者人身損害的事故。(摘自衛(wèi)生部《醫(yī)療事故處理條例》)
6.平均百萬人口報告數(shù):平均每1百萬人口中收到的可疑醫(yī)療器械不良事件報告數(shù)。
